【规划试验计划】:判别假定2是否建立,要害判别蜕变的漂白粉中是否含有Ca(ClO),过程Ⅱ参加稀盐酸,经过弄清石灰水辨别是否含有碳酸钙;过程Ⅱ运用次氯酸的漂白性判别是否含有次氯酸,然后判别是否含有次氯酸钙.解:【原理剖析】:工业上制取漂白粉是用氯气与石灰乳反响制得,反响的化学方程式为:2Cl
【提出假定】:依据假定1和假定3可知,假定2应该为:该漂白粉部分蜕变,含CaCl2、Ca(ClO)2、CaCO3,
【规划试验计划】验证假定2是不是正确的办法为:过程I:取少数样品于一支试管中,向其间参加适量1 mol?L-1盐酸,塞上带导管的单孔塞,将导管另一端刺进盛有足量弄清石灰水的试管中,若有气体放出且能使弄清石灰水变污浊,则假定2或许建立;若无气体放出,则假定2不建立;
过程II:向过程I反响后的溶液中滴入几滴品红溶液,振动,若品红溶液褪色,且过程I中有气体放出,则假定2建立;若品红溶液不褪色,则假定2不建立,
若有气体放出且能使弄清石灰水变污浊,则假定2或许建立;若无气体放出,则假定2不建立
若品红溶液褪色,且过程I中有气体放出,则假定2建立;若品红溶液不褪色,则假定2不建立
本题考察了物质性质试验计划的规划办法,标题难度中等,正确剖析题干信息清晰试验原理为回答要害,留意把握漂白粉的组成、漂白粉的制取原理,试题偏重考察了学生的剖析、理解才干及灵敏运用所学常识的才干.
(2)若量取该混合液100ml,将其加水稀释至1L,则稀释后所得溶液中Cl-的物质的量浓度为多少?

(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式.
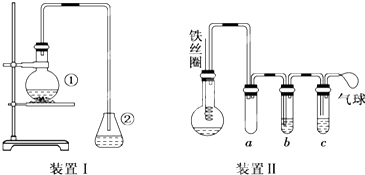
(3)烧瓶中生成的红褐色油状液滴的成分是,要想得到纯洁的产品,可用试剂洗刷.洗刷后别离产品应运用的仪器是.
(4)甲做试验时,乙观察到烧瓶中液体欢腾并有红棕色气体从导管中逸出,提出必须先除掉红棕色气体,才干验证锥形瓶中的产品,原因是.
(5)乙同学规划如图所示设备Ⅱ,并用下列某些试剂完结该试验.可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳.a的作用是,b中的试剂是,比较两套设备,设备Ⅱ的首要长处是:(答出两点即可)①;②.
